Os modelos de todos os átomos revelam o novo mecanismo da nova proteína
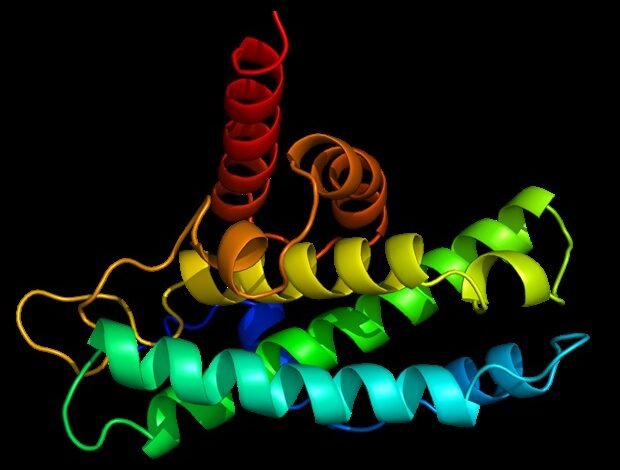
As novas simulações de computador que projetam cada uma das proteínas são suportadas enquanto se desenvolvem na sua última forma tridimensional de um tipo de infortúnio de proteína recentemente identificado. As proteínas em formas tridimensionais devem ser dobradas – chamadas de sua condição original – para desempenhar suas funções biológicas. Quando não são proteínas erradas, elas podem perder a função e, em alguns casos, contribuem para a doença. A inclusão recém -monitorada resulta em uma alteração na estrutura da proteína – um episódio que conecta outra seção de proteína quando não deve ou não deve perturbar sua função e pode continuar nas células, evitando o sistema de controle da qualidade das células. Misfolds também é intimamente consistente com as alterações estruturais extraídas de experimentos que seguem a proteína dobrável usando um espectro de massa, de acordo com a equipe liderada por pesquisadores na Pensilvânia.
“A proteína errada pode causar uma doença, incluindo a doença de Alzheimer e Parkinson, e acredita -se que seja um dos muitos fatores que afetam o envelhecimento”, disse Ed Operen, professor de química da Faculdade de Pesquisa. “Esta pesquisa representa outro passo adiante em nossa tentativa de documentar e entender os mecanismos de proteína errada. Nosso objetivo é traduzir essas descobertas básicas em objetivos de tratamento que podem ajudar a aliviar os efeitos desses distúrbios e até o envelhecimento”.
Um artigo que descreve a pesquisa hoje (8 de agosto) apareceu na revista de avanços científicos.
As proteínas consistem em cadeias longas de unidades chamadas aminoácidos. A função proteica depende da sequência desses aminoácidos ao longo da cadeia, que determina como a cadeia se dobra para uma estrutura 3D. As seções de proteínas podem dobrá -las em espirais, anéis, painéis e vários outros eventos que lhes permitem interagir com outras partículas e desempenhar suas funções. Qualquer erro durante esse processo de dobragem pode interromper essas funções.
A nova categoria de desdobramento, que foi recentemente identificada pelo O’Brien Lab, inclui uma mudança no caso de emaranhado na estrutura da proteína. Tânger indica seções da cadeia de aminoácidos que voam um com o outro, como lasso ou nó. Às vezes, o emaranhado pode se formar quando às vezes não há o emaranhado que representa parte da estrutura da proteína original não é formada quando deveria.
“Em nossos estudos anteriores, usamos uma simulação granular grossa que apenas projetou proteínas no nível dos aminoácidos, não no nível atômico”, disse Queen Fu, o primeiro autor do artigo e do pós -Phd em química na Pensilvânia, que iniciou a pesquisa como aluno de estudos de pós -graduação na Academia Polonosa de Sciências. “Mas havia ansiedade na sociedade de que esse modelo pode não ser realista o suficiente, pois as propriedades químicas e a ligação de átomos que compõem os aminoácidos têm um processo de dobragem. Portanto, queríamos garantir que ainda vemos essa categoria de emaranhado errado com simulações de precisão superior”.
A equipe pela primeira vez usou todos os modelos pequenos de proteínas e simulando dobrá -los. Eles descobriram que ambas as proteínas pequenas podem formar erros errados, como em simulações granulares grossas. No entanto, diferentemente das simulações anteriores, projetadas por proteínas de tamanho natural, os erros nessas pequenas proteínas continuaram apenas um curto período de tempo.
“Acreditamos que os erros nas simulações anteriores duraram duas razões principais”, disse Fu. Primeiro, para corrigir a ponderação necessária necessária e revelar várias etapas para corrigir a condição do emaranhado, e o segundo, o pecador pode ser enterrado profundamente dentro da estrutura da proteína e é principalmente invisível para o sistema de controle da qualidade das células. Com a presença de pequenas proteínas, havia cada vez menos etapas para escondê -las para que os erros possam ser corrigidos rapidamente.
A equipe também segue as proteínas usadas em simulações experimentalmente. Embora não tenham sido incapazes de levar em consideração os MISFolds diretamente nos experimentos, as alterações estruturais foram concluídas usando os blocos nos locais que estavam errados para simular.
“A maioria das proteínas que não ocultas é rapidamente reparada ou se deteriorando nas células”, disse O’Brien. “Mas esse tipo de emaranhado representa dois problemas principais. É difícil corrigi -los, porque pode ser muito estável e pode voar sob o radar dos sistemas de controle de qualidade celular. Operações de simulação de grãos grossas indicam que esse tipo de pecado é comum. Sabendo mais sobre o mecanismo pode nos ajudar a entender seu papel no envelhecimento e esperamos que indique os novos objetivos para os novos objetivos para o desenvolvimento.
Além de Vu e O’Brien, a equipe de pesquisa da Ian Citaric inclui um estudante de química; Yang Jiang, professor assistente de química; Hybin Song, Professor Assistente de Estatística, na Pensilvânia; Yingzi Xia, Piyoosh Sharma, Diveya Yadav e Stephen D. Fried, da Universidade Johns Hopkins; Mai Swan Lee, na Academia Polonosa de Ciências.
A Fundação Nacional de Ciências Americanas, os Institutos Nacionais Americanos de Saúde e o Centro Nacional de Ciências Polonês financiaram a pesquisa. A pesquisa foi parcialmente apoiada pelo Centro de Tarefas Corpermper em Gdansk, Polônia; Infraestrutura PLGrid na Polônia; O computador de super -herói está no Instituto de Ciência e Ciência de Dados da Pensilvânia.
fonte:
Referência do diário:
De qv, E outros. (2025) Proteína emaranhada nativa que foi observada nas operações de simulação Alle-Insom e é apoiada por grupos estruturais experimentais. Progresso científico. Doi.org/10.1126/sciaadv.adt8974.




