Uma mutação associada à expressão do gene da ALS e da demência
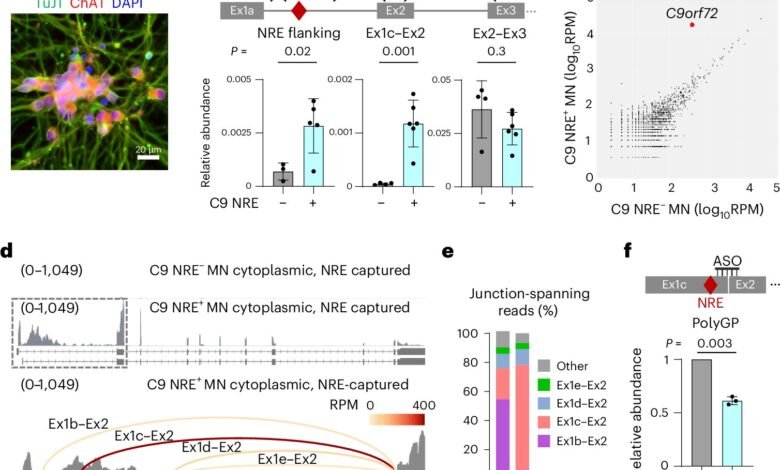
C9 Splicing aberrante em MNs pacientes-pacientes. Crédito: Neurologia da natureza (2025). Dois: 10.1038/S41593-025-02039-5
Este pode ser o momento de reconsiderar algumas mutações genéticas associadas a dois distúrbios neurodinativos desastrosos – esclerose lateral amiotrófica (ALS) e demência frontotemporal (FTD) – para um novo Neurologia da natureza Estudar De pesquisadores da Yale School of Medicine (YSM).
ALS é uma doença neurológica devastadora marcada pela degeneração progressiva das células nervosas no cérebro e na medula espinhal. Em alguns casos, a ELA pode ocorrer com FTD, um tipo de demência que danifica o lobo temporário e frontal do cérebro, resultando em uma mudança de comportamento, personalidade e fala.
Embora a maioria dos casos de ALS e FTD ainda seja desconhecida, as mutações genéticas desempenham um papel importante, especialmente nos casos em que há um histórico familiar desses distúrbios. A mutação genética mais comum na população européia e norte -americana com essas condições está localizada no gene C9orf72.
Curiosamente, ao contrário da maioria mutação genética Essa é a causa das doenças humanas, a mutação C9orf72 é chamada de íntron de genes. O íntron é geralmente considerado uma área “silenciosa” na maioria dos genes em nosso DNA. Enquanto o íntron e seus colegas são conhecidos como exon, a inicial é transferida para o RNA, o íntron é posteriormente removido durante um processo chamado Splissing, apenas o exon é deixado para fazer a fita madura de RNA mensageiro (mRNA) que leva instruções para coletar proteínas.
Portanto, não se espera que o íntron participe da proteína de produção. Mas uma exceção clara está no C9orf72.
Dentro do primeiro íntron desse gene, uma mutação faz com que uma pequena sequência de DNA repita uma pequena sequência de DNA centenas de vezes. De acordo com a compreensão específica do íntron, essas repetições, quando transferidas para o RNA, devem ser removidas pela divisão e não pela produção de proteínas. Mas estudos recentes mostraram que essas repetições realmente produzem proteínas repetidas tóxicas que podem se acumular no cérebro e na medula espinhal, possivelmente contribuindo para a neurodizonação.
“Isso pode interferir em uma ampla gama de funções de células de proteínas repetidas”, Sujou Yang, um doutorado. Aluno e principal autor do estudo no Programa de Neurociência Interdptmática de Yale. “Mas tem sido um segredo como uma sequência íntima, que geralmente é cortada e humilhada, pode ser traduzida para essas proteínas tóxicas”.
Mas agora, Yang e Junaji Guo, PhD, Professor Associado da Neurociência e autor sênior do estudo destacaram um mecanismo importante que ajuda a resolver esse mistério. Em seu estudo publicado em 11 de agosto, a ALS e a FTD têm a capacidade de expandir as possibilidades terapêuticas e fornecer informações sobre outras doenças associadas a mutação semelhante.
Splicing aberrante converte o íntron em exon
Um grande desafio na compreensão da biologia da mutação C9orf72 tem sido muito pouca abundância de moléculas de RNA mutantes em células pacientes – muito não está disponível para trabalhar com ela. Para superar esse desafio, Yang e Guo desenvolveram um novo método para separar e marcar essas moléculas raras de RNA.
Isso lhes permitiu descobrir uma peça importante do quebra -cabeça sobre o motivo pelo qual a repetição não foi removida por meio de divisão – o íntron em questão realmente se torna parte de um exon.
Geralmente, a maquinaria de derramamento da célula remove o íntron adequadamente do RNA e leva de volta o vizinho exon. Mas, neste caso, a presença de seqüências de repetição está errada de alguma forma Máquinas de respingoManter uma parte do íntron, incluindo a repetição no RNA maduro.
“Por esse motivo, levamos tanto tempo para descobrir que é a nossa maneira estável de pensar sobre a expressão do genoma e do gene”, diz Guo. “Mas uma vez que vimos a sequência de RNA, esse processo incomum foi imediatamente para nós”.
Eles descobriram que o fator de divisão pré -conhecido desempenha um papel na formação do padrão rude de divisão. Além disso, colaborando com seus colegas do iPSC-neucore no Departamento de Neurociência de Yale, ele percebeu que vários tipos de células que transportam a mesma mutação, como fibroblastos da pele e neurônios motores, exibem diferentes resultados de divisão.
Mais pesquisas ainda precisam ser totalmente compreendidas sobre como a sequência de repetir a emenda aberrante C9orf72.
“É mais provável que existam reguladores divididos específicos para células que determinam os locais de emenda errados”, diz Guo. “Se conseguirmos identificar esses reguladores, eles podem se tornar um possível objetivo para manipular e reverter esses eventos incomuns”.
Expandir possibilidades terapêuticas para ALS e FTD
Com cerca de 10% de casos de ALS devido a essa mutação C9orf72, os resultados de Yang e Guo indicam novas possibilidades para o tratamento com ELA e FTD. O trabalho no primeiro desenvolvimento médico se concentrou em abolir o RNA repetindo o C9orf72 para reduzir a produção de proteínas tóxicas e diminuir a neurodizonação. Um defeito comum das abordagens atuais, no entanto, é que elas lutam para distinguir entre repetição e RNA prejudicial com mRNA normal que codificou uma proteína importante.
Novas conclusões apontam para uma nova abordagem que se dividindo incorretamente ou resultando em RNA. Como prova da teoria, os pesquisadores projetaram moléculas que se conectam seletivamente à junção Splis Abracent, uma sequência única existe apenas nos RNAs repetidos. Trabalhando com seus colegas da clínica Mayo, os pesquisadores descobriram que essas moléculas reduziram efetivamente os RNAs de repetição prejudicial e seus produtos proteicos.
“Do ponto de vista terapêutico, acreditamos que é uma estratégia amplamente aplicada para identificar sequências exclusivas que nos permitem atingir os RNAs que têm seletivamente doenças que causam RNAs”, diz Guo.
Mas há outra grande passagem de estudo.
“Devemos ter cuidado com a classificação Mutação De acordo com o atual modelo de gene, “diz Guo”. Porque acontece, um íntron nem sempre permanece Intron,,
Mais informações:
Suzau Yang et al., A divisão Abracent aumentou a expansão C9orf72 repetida em ALS/FTD, Neurologia da natureza (2025). Dois: 10.1038/S41593-025-02039-5
fornecido por
Universidade de Yale
CitaçãoUma mutação associada à expressão de Misswiers ALS e Demência Jean (2025, 13 de agosto) foi retirada de https://medicalxpress.com/news/2025-08-08–1rutor- Linked- Linked-Mantia-Miswires.html em https://medicalxpress.com/news
Este documento está sujeito a direitos autorais. Além de qualquer comportamento imparcial para fins de estudos ou pesquisas privadas, nenhuma parte pode ser retroduzida sem permissão por escrito. O conteúdo é fornecido apenas para fins de informação.




